近期,隨着新冠病毒迅速傳播,老年人等高風險人羣面臨被感染的風險,急需加強防護措施。
12月14日,國家衞健委印發《新冠病毒疫苗第二劑次加強免疫接種實施方案的通知》,可在第一劑次加強免疫接種基礎上,在感染高風險人羣、60歲以上老年人羣、具有較嚴重基礎性疾病人羣和免疫力低下人羣中開展第二劑次加強免疫接種。截至目前,我國已批准13款新冠疫苗,8款被推薦為第二劑次加強免疫接種。
《實施方案》提供了9種接種組合方案,其中,8種方案為3劑滅活疫苗後接種1劑其他技術路線的新冠疫苗,1種方案是在2劑康希諾肌注式腺病毒載體疫苗+1劑康希諾吸入用重組新冠病毒疫苗(5型腺病毒載體)。具體組合如下:
3劑滅活疫苗+1劑康希諾肌注式重組新冠病毒疫苗(5型腺病毒載體);3劑滅活疫苗+1劑智飛龍科馬重組新冠病毒疫苗(CHO細胞);3劑滅活疫苗+1劑康希諾吸入用重組新冠病毒疫苗(5型腺病毒載體);3劑滅活疫苗+1劑珠海麗珠重組新冠病毒融合蛋白(CHO細胞)疫苗;2劑康希諾肌注式腺病毒載體疫苗+1劑康希諾吸入用重組新冠病毒疫苗(5型腺病毒載體);3劑滅活疫苗+1劑成都威斯克重組新冠病毒疫苗(sf9細胞);3劑滅活疫苗+1劑北京萬泰鼻噴流感病毒載體新冠病毒疫苗;3劑滅活疫苗+1劑浙江三葉草重組新冠病毒蛋白亞單位疫苗(CHO細胞);3劑滅活疫苗+1劑神州細胞重組新冠病毒2價S三聚體蛋白疫苗。
從方案來看,用於第二針加強免疫的組合方案,囊括除5款滅活疫苗外的所有8款已上市疫苗。方案建議優先考慮序貫加強免疫接種,或採用含奧密克戎毒株或對奧密克戎毒株具有良好交叉免疫的疫苗進行第二劑次加強免疫接種。
智飛生物接種範圍擴大至3歲以上
12月25日,國務院應對新型冠狀病毒肺炎疫情聯防聯控機制綜合組發佈通知,對智飛龍科馬重組新型冠狀病毒蛋白疫苗(CHO細胞)的接種人羣範圍進行調整,並實施同源加強免疫接種。
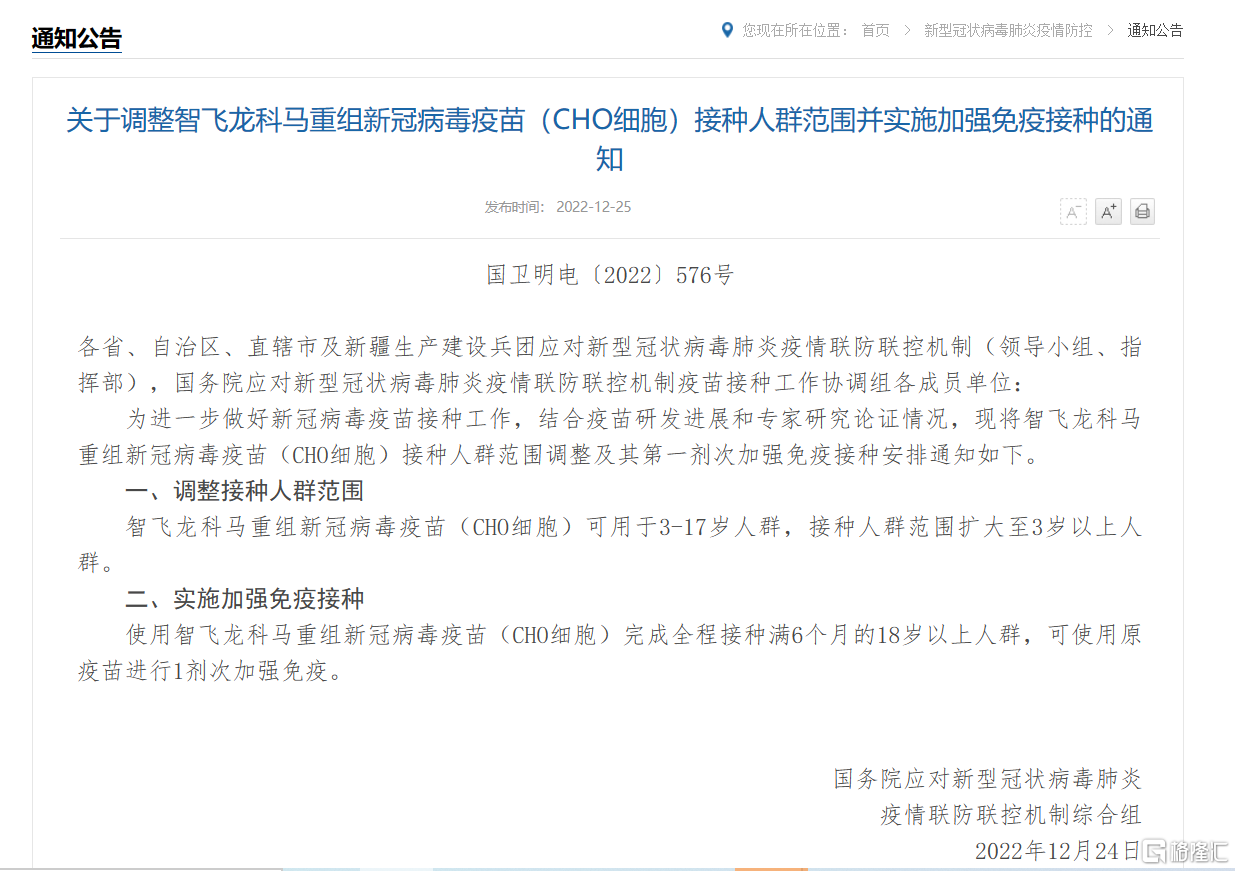
通知顯示,智飛重組新冠蛋白疫苗接種人羣範圍擴大至3歲以上人羣(大於17歲人羣也可接種)。使用智飛龍科馬重組新冠病毒疫苗(CHO細胞)完成全程接種滿6個月的18歲以上人羣,可使用原疫苗進行1劑次加強免疫。
據悉,重組新型冠狀病毒蛋白疫苗(CHO細胞)由智飛生物全資子公司安徽智飛龍科馬生物製藥有限公司與中國科學院微生物研究所聯合研究開發,於2021年3月10日獲批國內緊急使用;2022年2月19日獲國家批准作為新冠滅活疫苗的序貫加強疫苗;2022年3月1日獲批國內附條件上市,成為首個獲批的國產重組新冠病毒蛋白疫苗。
根據臨牀試驗的結果顯示,智飛龍科馬重組新冠蛋白疫苗具有一定的廣譜性,對原始株、Alpha株、Delta株、Omicron株等都均有較好效果。
市場迎來新機遇
目前我國新冠毒株主要是奧密克戎,自2021年12月傳入我國,具有傳播速度快、隱匿性強、傳染性強等特點,同時奧米克戎毒株也不斷進化成不同分支/亞型,從BA.1、BA.5到BF.7,其中BF.7傳播力更強。
面對來勢洶洶的新冠病毒,以及第二劑次加強免疫接種實施方案發布,疫苗企業又將迎來新的發展機遇。
康希諾早前在投資者互動平台上對供應等做出迴應:公司對吸入用新冠疫苗的大規模使用進行了提前佈局以保障及時供應,包括霧化設備和耗材;目前公司的吸入用新冠疫苗已在國內多個省市逐步開始使用,基於目前的加強針市場需求,公司能夠及時、充足供應。
12月19日,康泰生物發佈消息,公司自主研發生產的新冠滅活疫苗第二劑次加強針已開放公眾預約接種。康泰新冠疫苗目前已在全國16個省(直轄市),包括北京、上海、廣東、江蘇、浙江、河南、四川、陝西、湖南、安徽等地開放“第四針”預約接種。
同日,珠海市市場監督管理局召開新聞通氣會,通報珠海市藥械防疫物資等情況。麗珠單抗生物技術有限公司研發的“重組新型冠狀病毒融合蛋白疫苗”近日經國家衞生健康委等部門組織論證,正式獲批納入新型冠狀病毒防疫序貫加強免疫緊急使用,日均產能達150萬劑。



