最高減重20%!禮來“替爾泊肽”在華獲批,效果強過司美格魯肽?
7月19日,國家藥監局官網公示,禮來申報的穆峯達(替爾泊肽注射液)長期體重管理適應證獲得批准,這也是禮來肥胖治療領域在中國獲批的首個創新藥物。
根據禮來早先發布的新聞稿,替爾泊肽注射液本次獲批的適應症為:用於在低熱量飲食和增加運動基礎上改善成人肥胖或伴有至少一種體重相關合並症的超重患者長期體重管理。而在今年5月,替爾泊肽已經在中國獲批首個適應症,用於成人2型糖尿病患者血糖控制。
此前,6月份國家藥監局批准了諾和諾德研發生產的諾和盈(司美格魯肽注射液)在中國的上市申請。截至目前,減重屆的兩大火爆單品均已在我國獲批。
兩大巨頭逐鹿中原
據禮來透露,此次獲批的穆峯達(替爾泊肽注射液)將在中國用於長期體重管理。今年5月,替爾泊肽已經在中國獲批首個適應症,用於成人2型糖尿病患者血糖控制。
替爾泊肽是一款葡萄糖依賴性促胰島素多肽(GIP)和胰高血糖素樣肽-1(GLP-1)受體激動劑,每週一次注射。替爾泊肽通過減少熱量攝入和調節食慾來減少食物攝入、降低體重並降低脂肪含量。此外,替爾泊肽也已被證實可調節脂質利用。
2022年5月,替爾泊肽獲美國FDA批准用於改善成人2型糖尿病患者的血糖控制(在飲食控制和運動基礎上);2023年11月,產品獲FDA批准用於肥胖(BMI≥30 kg/㎡)或至少有一種合併症的超重成人(BMI≥27 kg/㎡)的長期體重管理(在低熱量飲食和增加體力活動基礎上)。替爾泊肽還於2023年入選了素有“醫藥界的諾貝爾獎”之稱的蓋倫獎“最佳醫藥產品獎”。
一直以來,禮來與諾和諾德被認為是減肥藥界的兩大巨頭,而諾和諾德的司美格魯肽先一步在中國市場獲批。
1月26日,諾和諾德司美格魯肽片獲國家藥品監督管理局批准上市,6月25日,國家藥監局批准了諾和諾德用於長期體重管理的司美格魯肽注射液在國內的上市申請。
司美格魯肽作為新型長效胰高血糖素樣肽-1受體激動劑類似物,是一類新型降糖藥。該藥物在治療2型糖尿病時,通過促進胰島β細胞分泌胰島素和抑制胰島α細胞分泌胰高血糖素,降低血糖水平。對於存在肥胖的2型糖尿病患者而言,使用該藥物也可以減緩胃排空、減少能量攝入,達到減輕體重的效果。
對比兩款產品的減重效果,替爾泊肽可以算是更勝一籌。
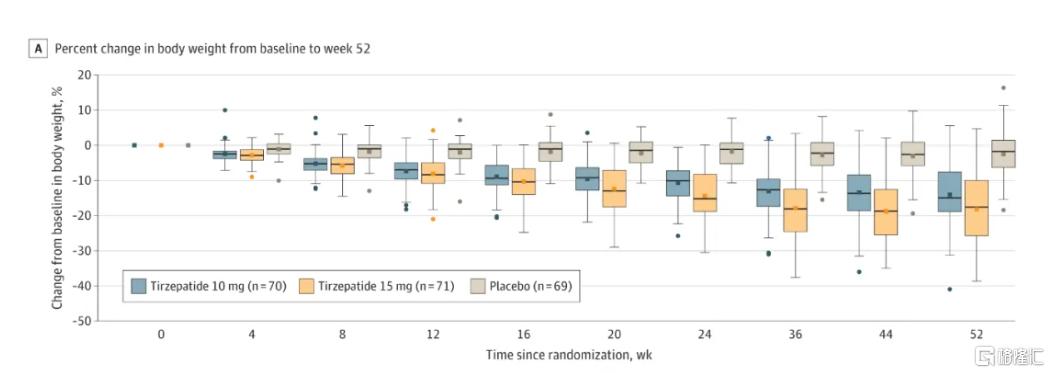
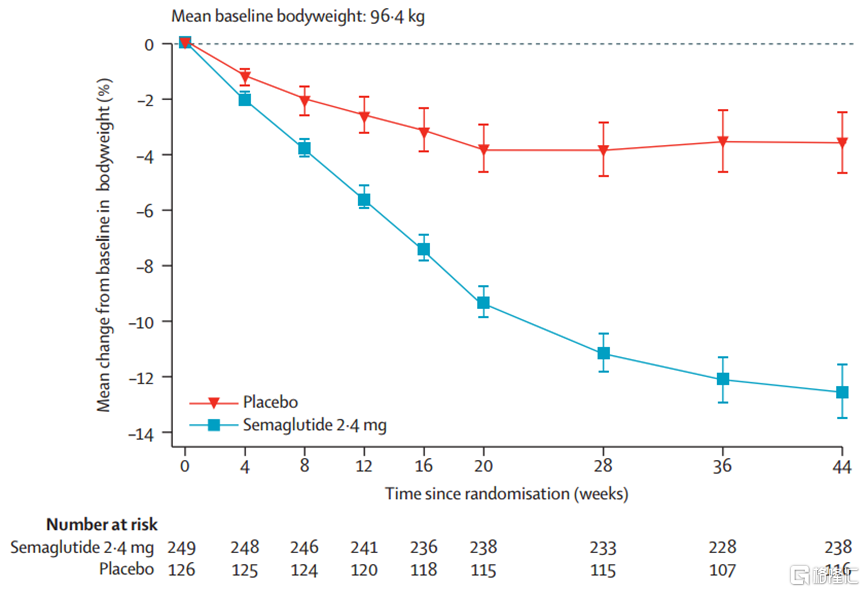
替爾泊肽中國人羣研究SURMOUNT-CN結果顯示,使用10mg劑量52周(一年左右),可實現減重13.6%,使用15mg劑量52周,可顯著減重17.5%;司美格魯肽STEP 7研究中納入的70%是中國人,使用司美格魯肽44周(10個月左右)可實現體重12.1%的降幅。
減肥藥賽道火熱
值得關注的是,新型減肥藥物正在改變人們的生活方式,它們能夠在不依賴傳統節食和運動的情況下幫助人們顯著減重。
據相關機構預測,未來6年中國的糖尿病(和減肥)藥物市場規模將增長1倍以上,超過230億美元(約合人民幣1700億元)。同時,高盛估計,到2030年全球減肥藥市場的規模將飆升至1000億美元(約合人民幣7200億元)。
在此背景之下,GLP-1減重藥物逐漸成為市場的新風口,國內外藥企也競爭激烈。
2023年7月,華東醫藥的利拉魯肽注射液(利魯平)、仁會生物的貝那魯肽注射液(菲塑美)用於肥胖或超重適應症的上市許可申請先後獲批。相關負責人表示,利拉魯肽注射液已在超過1000家大型醫院實現入院銷售,公司也在佈局線上平台及線下藥店等。
6月22日甘李藥業自研的GLP-1受體激動劑GZR18注射液在中國肥胖/超重人羣中的Ib/IIa期臨牀研究結果顯示,GZR18治療35周後,GZR18 QW組體重較基線平均降低17.8%。
翰宇藥業的替爾泊肽原料藥收到FDA的DMF備案號,在同品種的市場競爭中,取得DMF註冊登記號的企業和產品容易被客户優先考慮。
國投證券分析師表示,從國產減肥創新藥的競爭優勢角度來看,開發進度快、臨牀減重數據和安全性數據優異、患者依存性好的產品具備相對的競爭優勢。
對於產品可提升患者依存性的企業,如延長產品用藥時長,或將用藥方式從注射優化為口服的企業,有望在減重這類慢病領域取得相對優勢。
Follow us
Find us on
Facebook,
Twitter ,
Instagram, and
YouTube or frequent updates on all things investing.Have a financial topic you would like to discuss? Head over to the
uSMART Community to share your thoughts and insights about the market! Click the picture below to download and explore uSMART app!

Disclaimers
uSmart Securities Limited (“uSmart”) is based on its internal research and public third party information in preparation of this article. Although uSmart uses its best endeavours to ensure the content of this article is accurate, uSmart does not guarantee the accuracy, timeliness or completeness of the information of this article and is not responsible for any views/opinions/comments in this article. Opinions, forecasts and estimations reflect uSmart’s assessment as of the date of this article and are subject to change. uSmart has no obligation to notify you or anyone of any such changes. You must make independent analysis and judgment on any matters involved in this article. uSmart and any directors, officers, employees or agents of uSmart will not be liable for any loss or damage suffered by any person in reliance on any representation or omission in the content of this article. The content of the article is for reference only and does not constitute any offer, solicitation, recommendation, opinion or guarantee of any securities, virtual assets, financial products or instruments. Regulatory authorities may restrict the trading of virtual asset-related ETFs to only investors who meet specified requirements. Any calculations or images in the article are for illustrative purposes only.
Investment involves risks and the value and income from securities may rise or fall. Past performance is not indicative of future performance. Please carefully consider your personal risk tolerance, and consult independent professional advice if necessary.






