今年以來,南下資金流入顯著。截止2021年2月2日,今年南向資金共計流入3443.77億元,繼續刷新南向資金流入總額。
與此同時,港交所允許未盈利生物科技類公司有條件納入港股通標的,也不斷吸引眾多南下資金投資醫藥板塊。其中,君實生物(1877.HK)成為首批進入港股通的18A類公司,自2月1日執行以來,公司股價持續走高,截止2021年2月3日收盤,月漲幅已經達到12.42%。
圖表一:君實生物(1877.HK)股價走勢圖
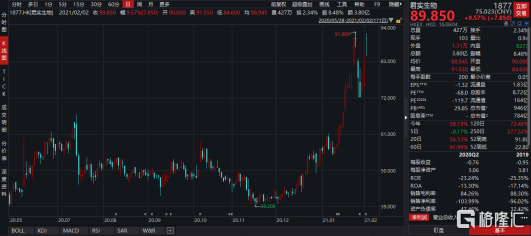
數據來源:WIND,格隆彙整理
2020年報營收預增105.14%
君實生物近期表現優異一方面來自於納入港股通標的,另一方面與其發佈的2020全年業績預吿有關。
根據公司公吿,預計公司在2020年營業收入達到15.9億元,同比增長105.14%,主要收入來自於核心產品特瑞普利單抗注射液(商品名:拓益®)快速提高醫院覆蓋率,產品銷售持續放量。
圖表二:公司營業收入情況

數據來源:WIND,格隆彙整理
2020年研發費用支出18.24億元,同比增長92.79%,主要用於研發推進臨牀項目的進展以及儲備研發項目的開發。目前共計擁有29項在研產品,包括27個創新藥,2個生物類似藥。公司共計開展臨牀試驗30餘項,覆蓋10多種腫瘤,其中關鍵註冊性臨牀15項。
圖表三:公司研發支出情況
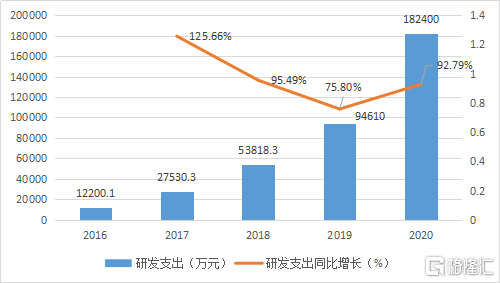
數據來源:WIND,格隆彙整理
PD-1產品即將進軍美國與加拿大
特瑞普利單抗(JS001或拓益®)作為國內首個獲批上市的PD-1國產單抗藥物,目前已經進入新醫保目錄。2月1日,君實生物發佈公吿稱與Coherus (Coherus Biosciences,Inc.)簽署了獨佔許可與商業化協議。換言之,公司的核心產品PD-1即將進軍美國與加拿大市場。
Coherus是一家總部位於美國加利福尼亞州的生物製藥公司,於2010年由生物技術產業的資深人士創立,當前已在納斯達克上市(CHRS.O),在美國和加拿大市場擁有廣泛影響力。
根據君實生物所簽署的許可與商業化協議,Coherus主要獲得三大權益:
(1)獨家美國與加拿大許可權。Coherus獲得在美國和加拿大境內開發、製造、商業化、銷售或以其他方式利用特瑞普利單抗(JS001或拓益®)的獨家許可,並獲得是否以同樣形式獨家使用JS006及JS018-1的選擇權。作為獲得特瑞普利單抗的對價,Coherus將在協議生效後一次性支付1.5億美元,並在達成規定的里程碑事件後支付最高3.8億美元的一次性里程碑款,同時支付含特瑞普利單抗產品的年銷售淨額的20%作為銷售分成。
(2)自主可選項目權。Coherus能自主選擇是否獲得JS006或JS018-1的獨家許可,每獲得一項將要一次性支付3500萬美元,為里程碑事件支付最高2.55億美元一次性里程碑款,提供相關產品的年銷售淨額的18%作為銷售分成。Coherus需要為每一款產品每年支付最高2500萬美元的合作開發費用。
(3)商業化優先談判權。君實生物協議賦予Coherus第三項權益則是能獲得後續免疫檢查點抑制劑的商業化優先談判權。
在此份PD-1出海公吿背後,應當看到更加深層的意義。
目前,全球已有10款PD-1/PD-L1抗體獲批上市,其中4款為國產產品。6款海外產品中有4款已在國內上市,而相對的國產產品無一在海外實現獲批上市。
與研發進程相匹配,國產產品在市場佔有方面也顯得落後。2019年全球PD-1/PD-L1單抗銷售額231.3億美元,同比增長51%,未來有望成為全球銷售額最大的藥品品類。而在這231.3億美元的巨量銷售額中,全球首款上市的歐狄沃和美國首款上市的可瑞達銷售額分別達到110.8億美元和80億美元,合計佔有全球PD-1/PD-L1單抗銷售額的82.49%。國產產品想在全球市場與存量巨頭進行競爭,首選進程就是擴大可銷售範圍,儘快在儘可能多的地區實現產品的商業化。
圖表五:全球已獲批上市的PD-1/PD-L1抗體
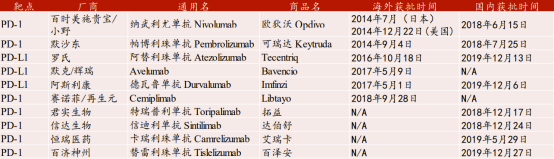
數據來源:WIND,格隆彙整理
通過獨佔許可來加速產品商業化進程的行為在同類公司中並非君實生物首創,但相比起同業其他藥企直接把全球獨家授予一家藥企的極端行為,君實生物的操作更為“精準”。公司針對合作企業銷售網絡的集中地區給予授權,即獲得了合作企業的銷售實力支持,又確保了自身企業在各大市場利益的最大化。
獲得市場準入便獲得了競爭機會。君實生物所生產的特瑞普利單抗從公開的數據上可得知該藥物用於治療二線及以上黑色素瘤臨牀試驗結果不弱於帕博利珠單抗(可瑞達),持續緩解有效時長及患者總生存時長明顯高於使用帕博利珠單抗的患者。公開的臨牀數據表明特瑞普利單抗在特定適應症上已經不弱於甚至領先海外產品。針對上述兩個藥物的國內用藥成本,君實生物所生產的產品用藥成本約為海外產品的70%,部分適應症僅為海外產品的35%。由小窺大,國產產品在海外市場上也將同樣具備價格優勢。
圖表六:特瑞普利單抗和帕博利珠單抗黑色素瘤適應症臨牀試驗結果對比
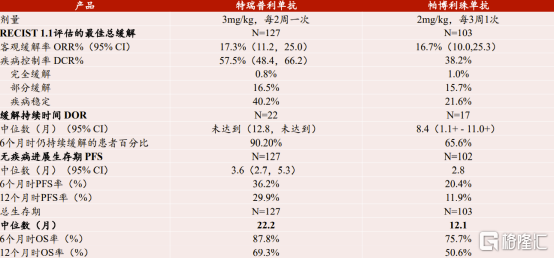
數據來源:CSCO,方正證券研究所,格隆彙整理
綜上產品競爭需求及企業發展需要,本次許可與商業化協議的簽署是君實生物建設全球商業化網絡的重要一步,將加快特瑞普利單抗及其他產品在海外的臨牀開發和市場開拓,為美國和加拿大的患者提供優質的的治療選擇,為君實生物的持續經營產生積極影響。
值得關注的是,除了已獲批的適應症之外,截至近期,特瑞普利單抗已在國內開展16項臨牀開發項目,多數處於臨牀後期試驗,後續擴大適應症範圍指日可待。
圖表四:關於JS001的臨牀開發項目

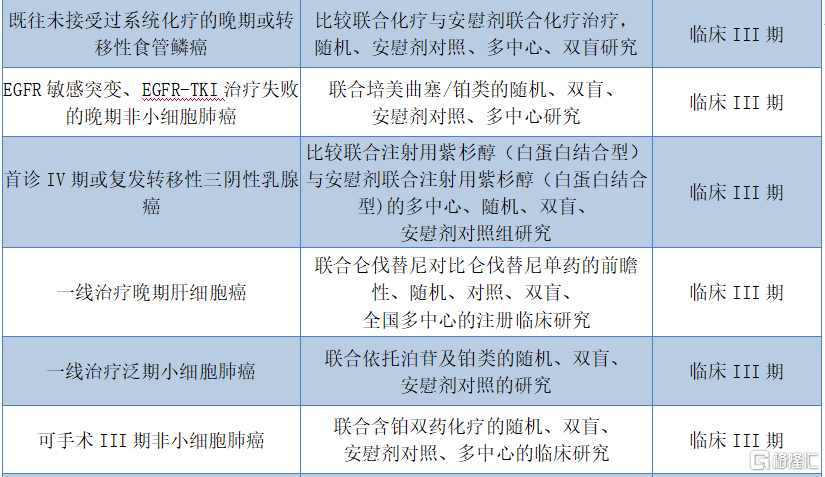

數據來源:招股説明書,格隆彙整理
新冠治療藥物到達臨牀Ⅲ期試驗主要研究終點
君實生物1月26日發佈公吿稱,重組全人源抗SARS-CoV-2單抗注射液(JS016)與LY-CoV555雙抗療法的臨牀III期試驗達到主要研究終點。
從臨牀數據上來看,etsesvimab(JS016/LY-CoV016)2800mg及bamlanibimab (LY-CoV555)2800mg雙抗體療法,能夠有效降低新冠高重症化風險患者相關住院和死亡事件。具體來看:
(1)事件發生率降低。在1035例患者中,雙抗體治療事件發生率為2.1%(11例),安慰劑組事件發生率為7.0%(36例),事件發生風險程度降低70%(p=0.0004)。
(2)安全性與前期試驗一致。臨牀III期試驗中,雙抗體療法的安全性特徵與評估與此前臨牀I/II/III期試驗觀察結果以止。
(3)嚴重不良反應率相似。雙抗體療法的嚴重不良事件報吿頻率與安慰劑組相似。
另外,公司正在通過BLAZE-4試驗來嘗試降低劑量來提高患者的覆蓋率,從而簡化給藥,併為皮下給藥提供更多的可能。
目前,試驗初步結果顯示,etsesvimab(JS016/LY-CoV016)1400mg及bamlanibimab (LY-CoV555)700mg雙抗體療法效果與etsesvimab(JS016/LY-CoV016)2800mg及bamlanibimab (LY-CoV555)2800mg雙抗體療法相似。
總體來看,自新冠疫情爆發以來,君實生物快速響應,與中科院合作開發的新冠病毒中和抗體JS016 研發順利推進,進度處於全球在研產品中第一梯隊。在2020年11月合作方禮來向FDA遞交緊急授權使用(EUA)申請之後,聯合用藥方案臨牀III試驗也達到主要終點,有望對全球抗擊新冠疫情做出重要貢獻,併為公司在2021年帶來超額收入。
小結
在港股熱浪中,新進軍港股通的18A公司正在吸引額外的關注。作為創新藥領軍的君實生物也在此時表現突出。結合此次公佈的年報預吿來看,公司營業收入超市場預期,同比增長105.14%,其中核心產品特瑞普利單抗(JS001或拓益®)納入醫保為公司帶來可觀收入,未來伴隨着公司擴寬至美國以及加拿大地區的海外市場,產品銷售額有望繼續提升。
從長遠來看,公司的研發投入加大,未來也將轉化成業績爆發的增長點。JS001後續適應症正在不斷推進,新冠中和抗體也已經到達臨牀III期主要終點,這些都將在近幾年為公司帶來可觀收入,值得期待。



