2020年3月30日,上交所披露科創板上市委2020年第7次審議會議結果公告,同意君實生物發行上市。君實生物長達半年的科創板之行終於步入了註冊階段,這也意味着君實生物將成為首家“18A+科創板”公司。而這家聯跨兩個資本市場新經濟板塊的生物科技企業,已經被高瓴資本青睞,併成為其重要股東之一。此前,君實生物發佈2019年報業績情況,在擁有PD-1成績單首秀後,還有那些研發亮點值得關注?
圖表一:君實生物科創板進程

數據來源:上交所,格隆彙整理
首個獲批上市的國產PD-1,好戲才剛剛開始
PD-1(Programmed death 1)是一種重要的免疫抑制分子,為CD28超家族成員。T細胞作為“人體衞士”,可以識別人體的腫瘤細胞並進行殺傷攻擊。在生存壓力下,腫瘤細胞會根據T細胞上的蛋白PD-1,產生PD-L1蛋白(PD-1的配體),與T細胞上的蛋白PD-1結合後發出抑制信號,從而阻止T細胞正常運作,並誘導T細胞凋亡。
自從發現腫瘤細胞抑制T細胞正常運作的機理後,眾多科學家開始針對PD-1/PD-L1靶點研發相應的藥物用作腫瘤治療。該類治療方法具備安全性高,具有針對性,副作用小等特點,國內外創新藥企爭先研製相應藥物。
圖表二:PD-1/PD-L1原理圖

數據來源:國盛證券,格隆彙整理
目前海外已有上市的K藥(Keytruda)和O藥(Opdivo),已形成頭部競爭格局,2019年全球銷售額分別為110.84億美元(YOY:55%)以及72.04億美元(YOY: 7%),並在國內也已經拿到批文上市。
但無論是K藥還是O藥,銷售額上百億美元的背後,不僅僅是藥物治療範圍廣的體現,同樣也是藥價高企的結果,這是許多患者難以承受的痛處。
在面對一年治療費用高達幾十萬乃至上百萬之時,國產PD-1在2019年已經開始獲批上市,成為諸多患者的新希望。隨後的新醫保政策調整,也將國產PD-1藥品納入醫保目錄範圍之內。而率先獲批上市的國產PD-1廠家,就是我們要討論的君實生物。
君實生物的董事陳列平博士,在醫學研發領域擁有超過35年的經驗,是PD-1/PD-L1靶點領域的先行者。陳列平博士早在1999年發現了B7-H1(亦稱為PD-L1)分子及證明了PD-L1在避免腫瘤微環境免疫中的作用。1999年至2002年建立PD-1/PD-L1途徑作為腫瘤免疫療法的靶點,並在2006年發起並協助舉辦用於治療人類癌症的抗PD-1單克隆抗體的首次人體臨牀試驗,開發PD-L1染色作為預測治療結果的生物標誌物。
而君實生物的特瑞普利單抗(JS001,商品名:拓益),是公司首個獲批上市的商業化創新藥品種,也是國內首個該靶點獲批創新藥品種。公司自 2015 年進行臨牀 IND 申報,到 2018 年 12月17 日正式獲得 NMPA有條件批准上市,用於治療既往標準治療失敗後的局部進展或轉移性黑色素瘤。
作為劃時代的重磅產品,特瑞普利單抗(拓益)自 2019 年2月底開始正式出貨銷售,上市定價僅為進口藥品的約1/3,通過買4贈4的贈藥政策,年治療費用大約降至9萬元左右,成為全球最低價,極大的滿足了中國病患的可承受能力。
根據君實生物 2019 年報披露,特瑞普利單抗的銷售額7.74億元,那麼他是否就抱着黑色素瘤領域賣就好了?其實並不是,PD-1/PD-L1賽道之所以有許多創新藥企在研究,其魅力就在於他的廣譜性,適應症範圍廣,換言之,PD-1上的PK還在繼續,好戲才剛剛開始。
目前,公司在特瑞普利單抗新適應症拓展上,共計擁有14個關鍵註冊臨牀正在開展。
從競爭格局上來看,特瑞普利單抗已上市的黑色素瘤適應症,以及已完成臨牀 II 期試驗、 將要申請上市的鼻咽癌和尿路上皮癌都是療效確切且競爭格局較好的適應症,能夠保證產品上市早期銷售額快速提升。特瑞普利單抗在 三陰性乳腺癌、小細胞肺癌中的臨牀進展也處於領先地位。
在非小細胞肺癌、肝癌和食管鱗癌三個大癌種中,競爭最為激烈的一線治療晚期EGFR 陰性非小細胞肺癌、肝細胞癌和食管鱗癌適應症,特瑞普利單抗已經啟動了臨牀 III 期試驗,進度在國產產品中較為靠前。更重要的是,特瑞普利單抗已經啟動了EGFR突變 TKI 治療失敗晚期非小細胞肺癌、非小細胞肺癌新輔助治療和肝癌輔助治療的臨牀III期試驗,在大癌種競爭格局更好的細分病人羣體中處於領先位置。
此外,特瑞普利單抗在海外市場佈局也已啟動,一線聯合化療治療晚期鼻咽癌為亞太多中心臨牀 III 期試驗,在美國已經進入臨牀 Ib 期試驗。特瑞普利單抗聯合阿昔替尼治療黏膜黑色素瘤更是獲得了FDA的孤兒藥認定,在這一細分適應症上有着突出的臨牀價值。此前,基於國內人羣的臨牀Ib期研究發現,特瑞普利單抗聯合阿昔替尼治療黏膜黑色素瘤取得了突出療效,ORR為 48.3%,DCR為 86.2%,中位無進展生存期達到了7.5個月。
除了針對特瑞普利單抗進行單藥研究外,公司也在積極與其他創新藥企合作,啟動聯合用藥的臨牀研究試驗。目前,特瑞普利單抗已與和記黃埔的索凡替尼、海和生物的德立替尼、天境生物的 TJ004309、亞盛醫藥的 APG-1387 以及中科院上海藥物所的谷美替尼聯合用藥的臨牀試驗都已啟動,多項合作研究尚處於臨牀前階段,未來將逐漸啟動。
在加大自主研發投入之外,公司還通過藥物的權益引進(license-in)的方式,補強腫瘤領域的產品管線。目前,公司已從Anwita引進的IL-21,從華奧泰引進的Avastin Biosimilar,從潤佳引進的CDK和PI3K,以及從多禧引進的Trop-2 ADC。公司引進的腫瘤領域藥物,每個單藥在技術和進度上都處於行業領先水平,同時也可以作為PD-1聯用的探索,使得特瑞普利單抗進一步擴大適應症範圍,具有差異化競爭優勢。
圖表三:特瑞普利單抗的關鍵註冊臨牀試驗
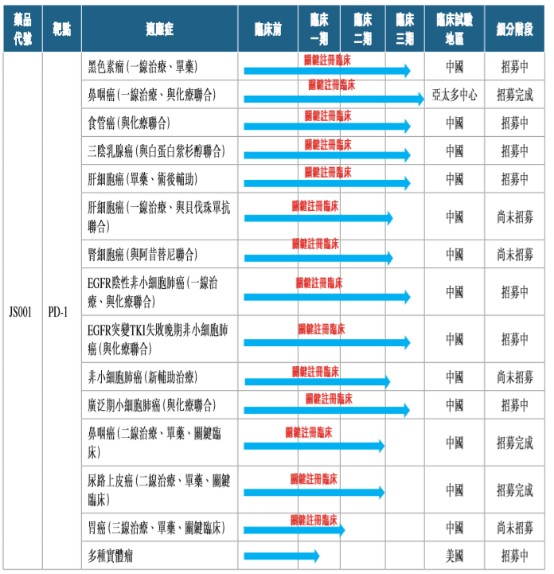
數據來源:公司公告,格隆彙整理
下一個重磅藥:全球首創BTLA單抗
伴隨着特瑞普利單抗開啟了商業化進程,君實生物的財務狀況也得到了明顯的改善,營業收入開始按照億作為單位入賬了。在我們一邊等待着特瑞普利單抗更多適應症獲批上市消息的同時,也在思考,公司接下來是否還有重磅產品可以期待?答案是有的。我們來看一下君實藥業下一款重磅藥:全球首創BTLA單抗(JS004)。
BTLA 是一種重要的免疫檢查點分子,被阻斷後能提高淋巴細胞功能。BTLA是在2003年被發現的一種重 要的免疫檢查點分子,與 PD-1 同屬於CD28超家族共刺激分子,BTLA有着與 PD-1 相似的結構和信號轉導機制。BTLA 主要表達在活化的B細胞和分化中的T細胞,通過與來自TNF受體家族的HVEM 受體結合來發揮作用。基礎研究發現BTLA 對T細胞的活化起負向調控作用,所以通過抗體阻斷 BTLA 發揮作用,可以提高淋巴細胞功能,調控機體的腫瘤免疫功能。
圖表四:JS004作用機理
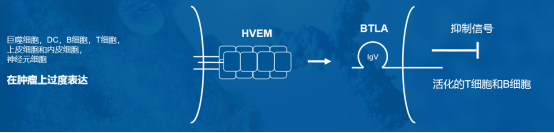
數據來源:公司資料,格隆彙整理
JS004 是全球首個通過 FDA的IND審批的BTLA 靶點藥物。JS004 是君實生物自主研發的 BTLA 單抗, 2019年年初通過 FDA的IND審批,是全球首個通過FDA的IND審批的抗BTLA 單抗藥物,目前已經開始 I 期臨牀患者入組,同時在中國也啟動了I期臨牀試驗。
從早期實驗數據來看, JS004 適用範圍廣,具有廣譜抗癌效果。根據 JS004 的臨牀前試驗結果,其可以通過單藥或者和特瑞普利單抗協同從而促進 T 細胞。同時動物實驗結果顯示,在 BTLA 人源化小鼠的腫瘤模型裏,JS004 能夠減輕腫瘤負荷並提高小鼠存活率,而且 JS004 能夠用在抗 PD-1 單抗治療無效的情況。公司在基礎研究中發現,降低 BTLA 表達水平有抵抗黑色素瘤、乳腺癌的作用,而 BTLA 和配體 HVEM 在胰腺癌、非小細胞肺癌、肝癌患者的淋巴組織中也有高表達。
目前,公司在美國開展的 I 期臨牀試驗就是在PD-1 抗體耐藥的實體瘤病人中展開的。此外與抗 PD-1 單抗聯合用藥也在同步試驗,預計在I期擴展組進行與特瑞普利單抗的聯合治療的嘗試。
從競爭情況來看,JS004屬於First-in-Class 類產品,市場競爭較小。抗 BTLA 單克隆抗體市場競爭較小,目前全球暫無其他競爭對手進入臨牀階段。默沙東曾做過相關臨牀前動物實驗,他們的實驗結果顯示聯用抗 BTLA 單抗增強了抗 PD-1 單抗的抗腫瘤情況,並於 2017 的AACR 國際會議上展示了該結果。未來,公司如果能夠順利開發,有望與公司的 PD-1 進行協同成為下一個重磅產品,獲得高額收益。
新冠肺炎藥物研發:中和抗體
2020年的春天,和以往格外不同。新型冠狀病毒席捲全球,對於創新藥企而言,許多臨牀試驗都需要暫緩進行,唯獨關於新冠肺炎相關治療的藥物研發,正在加速進行。
對於很多企業而言,是否接急性傳染病項目,是值得考量的,因為很多時候還沒有研發成功上市傳染病就已經結束(SARS就是疫苗未能上市就已經消失)。因此,只有有最強的研發實力,最高的研發效率,最強的生產能力才能在第一時間接受挑戰,快速投入到研發新藥當中去。
根據最新的公司公告顯示,目前,君實生物已經與中科院微生物所簽署協議,合作開發新冠病毒(Sars-Cov-2)中和抗體(JS016)。
中和抗體(Neutralizing antibodies, Nabs)是在適應性免疫應答中由 B 淋巴細胞分泌的一種抗體。病原體,特別是病毒表面通常會表達特定的可與宿主細胞表面受體結合的蛋白,稱為抗原。抗原與受體結合後,宿主細胞被感染,病毒進入宿主細胞並進一步擴增。中和抗體可與病原體的抗原特異性結合,阻止或中和抗原的某種生化活性,進而防止或阻斷病原體進入宿主細胞,從而達到預防和治療疾病的目的。
那麼此次新冠肺炎抗體的抗病毒機理是什麼?據瞭解,新冠肺炎病毒表面 S 蛋白的細胞受體結合區(Receptor binding domain,RBD)能夠和人體肺組織中的肺泡細胞等細胞表面的 ACE2 蛋白結合,從而侵入人體細胞內部,實現繁殖擴增,造成新冠肺炎的發生。病毒抗體能夠和新冠肺炎病毒表面S蛋白結合,競爭性抑制新冠肺炎病毒與人體細胞的ACE2蛋白結合,起到中和作用,保護人體細胞不被新冠肺炎病毒入侵。
圖表五:新型冠狀病毒中和抗體的研發策略
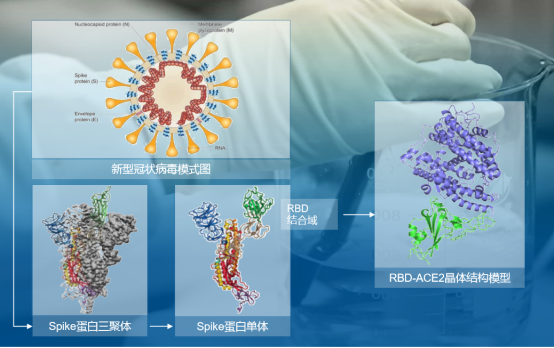
數據來源:公司資料,格隆彙整理
目前,體外試驗已顯示出非常優異的中和效果。公司已生產出實驗用抗體並且在200L大規模生產了多批抗體,目前正在進行2000L產能下的製備,已經開展了體外藥效研究和初步的恆河猴動物試驗:與微生物所合作,開展人類 ACE2轉基因小鼠的體內保護試驗;與武漢病毒所合作,在4月份開展大規模的恆河猴的保護試驗。預計動物試驗、藥效學及安全性評價將於4月完成。
同時,公司正與中、美、歐盟的藥監機構積極溝通,希望在安全性證明的情況下,儘快將候選藥物推進臨牀,在新冠患者中檢測療效。具體細節將在與全球監管部門討論後確定。
強大的產品管線,靠譜的研發平台
在研產品管線有多少,可以決定創新藥企未來能走多遠,而能夠有多少產品,靠的還是背後的研發平台能力有多強大。
總體來看,君實生物目前擁有在研產品21項,治療領域涉及腫瘤、慢性疾病、自身免疫、神經系統以及抗感染領域,產品類型包括單抗、融合蛋白、ADC、小分子藥物等多種類型。從研發進程上來看,進度比較快的包括已經上市的JS001(特瑞普利單抗),獲得NDA受理的UBP1211以及可能會加速研發進程的JS016中和抗體。
圖表六:在研產品管線

數據來源:公司資料,格隆彙整理
而這些研發成果,源自於公司建立之初就打造的完整的生物藥研發和產業化的平台,其核心平台達到國內領先,國際水準。
人體膜受體蛋白組庫和高通量篩選平台,包含了近 5,000 個人類細胞膜蛋白,具備高親和力和高靈敏度,能夠鑑定細胞表面上功能重要的蛋白質相互作用並檢查抗體結合。該平台是世界上最先進的腫瘤免疫和自身免疫靶點篩選和功能測定平台。君實目前已經進行人體臨牀試驗的BTLA即來自於這個平台,未來有望產出更多的全球新的產品。
抗體篩選及功能測定的自動化高效篩選平台,是公司另一個核心平台,該平台使公司能夠獲得特異和高親和力的靶向單克隆抗體,識別具有所需物理化學屬性的多種屬(人、猴、鼠)抗原。此平台大大增加了臨牀候選藥物篩選的初始範圍,有助於找到最優候選物,併為公司的創新單克隆抗體研發和體內外結合的功能性篩選提供了基礎。
高產穩定表達細胞株篩選構建平台,是公司將藥物研發和生產轉換有機結合的重要核心平台,打造了公司高效產業化的堅實基礎,使公司能夠完成高表達穩定細胞株的建立,較傳統技術在速度和產量上都有大幅提高。
君實將這些平台有機的組合,不僅打造了目前的管線,也能幫助君實研發全新的藥物,比如新冠肺炎的中和抗體,也發揮了巨大的作用。
小結
初識君實生物之時,來自於對於熱門靶點PD-1領域的研究,發現他是國內首個獲批上市的國產PD-1藥企,上市之初的定價直接定在全球最低價,讓更多的患者能夠用得起藥。
再次關注之時卻發現,君實並不僅僅是有一個PD-1那麼簡單,能夠做到第一個獲批,一定是有原因的。強大的研發產品管線,領先的研發技術平台,能夠做BTLA這類全球創新產品藥物,又能夠擁有足夠強大的能力快速尋找到新冠病毒的候選藥物。
在醫改政策進入深水區之際,能夠讓患者看得起病,吃得起藥,成為此次改革的核心目的。而這個想法,與君實生物的初衷不謀而合。憑藉創新研發走出自己的道路,在進口藥品高企之時,研發First-in-Class/Best-in-Class的藥品進行國產替代,好而不貴,為患者造福。



