格隆匯12月15日丨上海醫藥(601607.SH)公佈,近日,多家媒體就上海上藥康希諾生物製藥有限公司生產的重組新型冠狀病毒疫苗(5型腺病毒載體)實現量產下線相關事宜進行了報道。經核實,現就相關情況作如下説明:
為加速拓展疫苗生產領域,並切實做好上海市抗疫物資保障工作,公司下屬全資子公司上海三維生物技術有限公司(“三維生物”)與康希諾生物股份公司(“康希諾”)、上海生物醫藥產業股權投資基金合夥企業(有限合夥)(“生物醫藥基金”)共同出資成立了上海上藥康希諾生物製藥有限公司(“上藥康希諾”),註冊地址為上海市寶山區羅東路1377號,註冊日期為2021年2月2日,擬共同在上海市寶山區新建新冠疫苗生產基地。
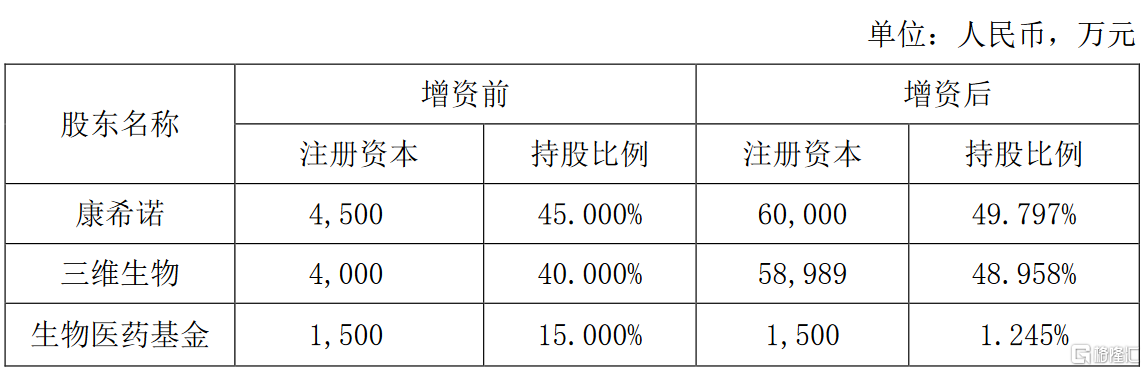
初始成立時,上海醫藥通過三維生物出資4000萬元,占上藥康希諾40.000%股權。2021年5月,三維生物與康希諾對上藥康希諾進行增資。增資後,公司對上藥康希諾的持股佔比增至48.958%,公司對其不實施並表控制。增資前後股權比例具體如下:
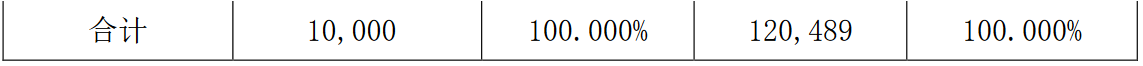
前期,上藥康希諾已取得上海市藥品監督管理局頒發的《藥品生產許可證》(編號:滬 20210226),批准上藥康希諾受康希諾委託於上海市寶山區羅東路1377號生產重組新型冠狀病毒疫苗(5型腺病毒載體)(“該藥品”)。該《藥品生產許可證》僅表明上藥康希諾的生產設備等硬件達到了上海市藥品監督管理局的要求,該藥品生產線還需符合各項動態檢查以及國家藥品監督管理局批准等程序。
近日,國家藥品監督管理局頒發《藥品補充申請批准通知書》(編號:2021B04466),批准上藥康希諾(上海市寶山區羅東路1377號)製劑2號線作為該藥品新增異地製劑生產線。
截至公吿日,上藥康希諾固定資產、無形資產投入及配套投入(主要包括設備試運行及信息化建設費用)合計約人民幣8.9億元。
上述事項未達到《上海證券交易所股票上市規則》及《上市公司信息披露管理辦法》所規定之信息披露標準。公司將按照國家有關規定積極支持上藥康希諾推進新冠疫苗後續生產等工作,並且按照規則要求及時進行信息披露。
為確保後續生產工作的順利開展,上藥康希諾需持續支出相關生產費用。截至公吿日,上藥康希諾對公司經營業績未產生重大影響,且公司對上藥康希諾不實施並表控制。敬請廣大投資者謹慎決策,注意投資風險。關於本次上藥康希諾產品生產尚存在以下風險:
1、重組新型冠狀病毒疫苗(5型腺病毒載體)為附條件上市,上市時該藥品的III期臨牀試驗仍在進行。
2、疫苗生產可能受到原料短缺、生產工藝等限制,未來產量存在不確定性。
3、截至公吿日,國內新冠疫苗產品已有數款獲附條件上市批准或者獲得緊急使用授權,另有多款處在臨牀試驗階段。該藥品未來的市場銷售將面臨較為激烈的競爭態勢,並同時受國內外疫情的發展變化、國家防疫政策、國內外新冠疫苗接種率等多種因素影響,後續市場情況存在不確定性。



