本文来自:天风研究,作者:杨松、徐晓欣
报吿摘要
“疫苗+检测+治疗药”闭环逐步形成,新冠疫情走向常态化
新冠疫情短期或不会消失,中长期防控闭环基本形成。中国实行动态清零策略,采取①疫苗接种建立免疫屏障、②通过核酸检测快速确诊患者、③使用多类药物开展治疗等多种方式。从投资角度,新冠产业链的驱动要素主要是国内和国外防控策略的变化以及产品供给端的进展,从防控政策方面看,全球各国正在推进新冠疫苗加强针的接种,海外国家主要以抗原检测为主,强制免费检测逐渐取消,中国抗原检测还未放开,新冠口服药尚未大规模应用于临床治疗。从供给方面看,目前中国的新冠检测试剂盒(核酸和抗原)、国内外疫苗的产能基本可以满足全球的需求,主要缺口在新冠口服药。
新冠抗原检测或成为中国疫情防控重要补充手段
根据最新表态“完善常态化防控和突发疫情应急处置机制,突出口岸地区疫情防控这个重点,守住不出现疫情规模性反弹的底线”。我们认为中国抗原检测或将成为疫情防控的重要补充手段,主要基于以下3点:1.国内抗原检测产品成熟,灵敏度可达90%;欧洲抗原检测已经实行了超过一年,对于疫情防控得到了验证。2.产品产能足够供应,2021年中国累计向海外出口668.93亿元金额的新冠检测试剂盒,企业扩产的周期较短。3.特定的应用场景需要抗原检测快速反应,例如港口、机场、海运等场所为高风险感染新冠病毒的场所,外卖员、出租车司机等流动人员为高风险传播源,这些场所和人群若感染新冠病毒扩散较广,疫情容易快速散播,每日进行核酸成本较高且检测速度较慢,抗原检测或提供较为便捷的管控。
中国新冠疫苗加强针接种将加速,序贯接种和同源接种同步推进
截至2022年2月25日,疫苗接种总人数为12.69亿,,已完成第三针加强免疫接种人数约5.54亿,未来第三针加强新冠疫苗接种需求约6.80亿人,占完成基础免疫的55%。目前序贯接种和同源接种一样为免费接种,优先在口岸、边境等重点地区实行,其他人群根据需要开展序贯加强免疫接种,我们预计第三针新冠疫苗各厂商将处于竞争状态。
新冠口服药供不应求,国产产品正在临床试验
目前已有2款新冠口服药获批上市包括默沙东Molnupiravir以及辉瑞的Paxlovid。新冠口服药的供不应求,辉瑞正在积极提升产能,根据辉瑞2021年年报数据,预计2022年上半年Paxlovid产量将达3千万疗程,下半年预计为9千万疗程,全年为1.2亿疗程。据默沙东公吿,截至2021年底已生产1000万疗程Molnupiravir,预计2022年将生产至少2000万疗程Molnupiravir。中国国产新冠药物RdRp抑制剂已经进入临床3期试验,包括君实生物、真实生物等;国产3CLpro抑制剂还处于研发早期,目前有前沿生物(注射剂)进入临床1期。
投资建议:
新冠疫情预计中长期与人类共存,疫情走向不确定因素较高,建议从三个维度筛选主题投资机会:1)需求持续性好,2)竞争格局较优,3)传统业务具备估值一定支撑。建议关注相关标的:
1)新冠抗原检测:东方生物、万孚生物、安旭生物、博拓生物、奥泰生物;
2)疫苗加强针:智飞生物、康希诺、康泰生物;
3)新冠药:君实生物、以岭药业;
4)CDMO供应链:药明康德、凯莱英、博腾股份。
风险提示
新冠病毒变异风险、新冠抗原检测放开不及预期、新冠疫苗接种不及预期、新冠药物研发不及预期、新冠药制备工艺存在不确定性为分析师主观预计、新冠药产业链公司参与存在不确定性等。
正文
1. 新冠防控新形势下,抗原或为重要的检测补充手段
1.1. 海外抗原检测应用已成熟,中国或将逐步完善防控手段
目前海外新冠检测以抗原检测为主。新冠检测的方法包括核酸、抗原和抗体,其中核酸检测为金标准,但需要专业的PCR仪器检测,等待时间较长;抗原检测适用于检测患病7天内的患者,反应速度较快,但灵敏度低于核酸,且存在假阴性的结果;抗体检测主要通过检测IgM或者IgG,判断是否感染过新冠病毒,但无法检测新冠病毒感染早期的人群,抗体检测存在窗口期。目前中国主要以核酸检测为主,海外欧美发达国家主要以抗原检测为主。2020年4月英国开始向公众提供免费抗原检测,12月15日美国FDA批准第一个抗原自检试剂盒上市,11月1日澳大利亚开始进行新冠抗原居家自检。2021年全球疫情第二波爆发后,3月6日德国首先开始出售新冠抗原自检试剂盒,每人每周可免费接受一次检测。


抗原检测灵敏度低于核酸,在大流行下可快速检出,助力疫情防控。根据Science的研究,新冠患病率对于抗原检测的效果不同,当人群中新冠患病率下降时,抗原检测试剂盒的假阳性人数上升,假阴性人数下降。斯洛伐克使用抗原检测普检的初期,新冠患病率高达3.9%,根据Pavelka的统计模型,抗原检测普筛和其他疫情防控措施降低了70%疫情传播。

抗原检测产品较多,灵敏度为产品性能判断的核心指标。根据不完全统计,目前欧盟CE认证的中国抗原检测产品共有94个,美国EUA有3个产品,新冠抗原检测拿证产品较多,判断产品优劣的指标主要是灵敏度,即假阴性,核酸检测的灵敏度在99%。根据Hvidovre Hospital对不同抗原检测试剂盒和大量的样品研究测试研究显示,灵敏度超过90%的抗原检测试剂共有9种,占比不到20%,灵敏度最低的仅有2.5%,其中艾康生物生产的新冠快检试剂的灵敏度高达94%,万孚生物和LumiraDx的灵敏度均为93%。
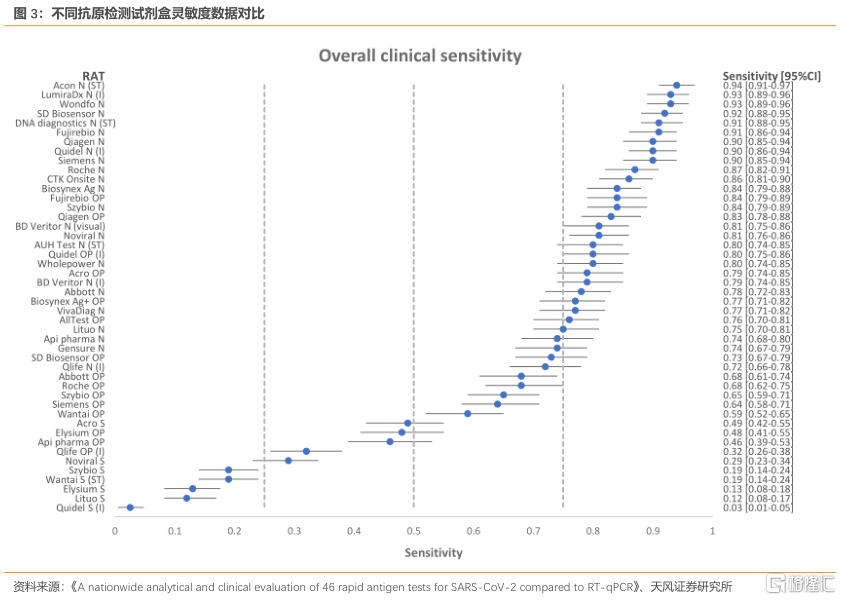

抗原检测或为中国新冠疫情防控的重要补充。我们认为抗原检测或逐步放开,主要基于以下3点:1.抗原检测产品成熟,灵敏度可达90%;欧洲抗原检测已经实行了超过一年,对于疫情防控得到了验证。2.产品产能足够供应,2021年中国累计向海外出口668.93亿元金额的新冠检测试剂盒,企业扩产的周期较短。3.特定的应用场景需要抗原检测快速反应,例如港口、机场、海运等场所为高风险感染新冠病毒的场所,外卖员、出租车司机等流动人员为高风险传播源,这些场所和人群若感染新冠病毒扩散较广,疫情容易快速散播,每日进行核酸成本较高且检测速度较慢,抗原检测或提供较为便捷的管控。
1.2.未来抗原自检市场:海外跟踪疫情确诊,中国跟踪政策放开
回顾2021年全年海外新冠检测需求量较大,目前逐渐放开检测量或下降。根据2021年全年检测量看,海外大部分国家平均每千人每日检测量在2-5次左右,疫情严重检测需求较大,秋冬季节(1-3月、10-12月)显著增加主要是由于新冠病毒变异导致感染人数增加。英国新冠检测从2020年4月开始免费检测,2021年全年平均每千人每日检测量约13.67次,全年新冠检测需求较高约3.31亿人份。2022年4月1日英国将取消新冠检测免费,新冠检测的需求或下降。目前海外检测要求放开,以英国为代表的国家检测需求量在下降,未来检测需求量增加主要变量是新冠疫情的严重程度,单日确诊人数激增,检测政策或发生改变。


海外市场中美国需求量较大壁垒较高,中国抗原自检试剂盒尚未获批。根据2021年平均每千人每天检测量在2-5次,中性假设2022年平均每千人每天检测3次,美国市场全年检测需求约3.24亿人份、欧洲市场约4.84亿人份,海外市场约65.88亿人份。新冠检测持续性主要是看新冠病毒的变异情况,Omicron病毒引起全球新冠疫情又一次大流行,检测需求激增。

2. 新冠疫苗加强针接种或将加速
2021年10月3日中国开始启动新冠疫苗加强针免费接种,针对接种国药中生北京公司、北京科兴公司、国药中生武汉公司的灭活疫苗和康希诺的腺病毒载体疫苗满6个月的18岁以上的人群可选择接种一剂相同的疫苗,为同源接种。2022年2月19日国家联防联控批准部署序贯加强免疫,即异源接种,针对已接种国药中生北京公司、北京科兴公司、国药中生武汉公司的灭活疫苗满6个月18岁以上的人群可以选择接种一剂智飞生物的重组蛋白疫苗或康希诺的腺病毒载体疫苗。序贯加强的组合有两种,分别为“灭活疫苗(2针)+重组蛋白疫苗(1针)”和“灭活疫苗(2针)+腺病毒载体疫苗(1针)”。

目前在海外已经有10个国家或地区批准进行异源加强,其中阿根廷和智利使用腺病毒载体疫苗进行加强免疫,印尼使用重组蛋白新冠疫苗进行加强免疫。

2.1.临床试验显示接种“加强针”中和抗体水平显著提升
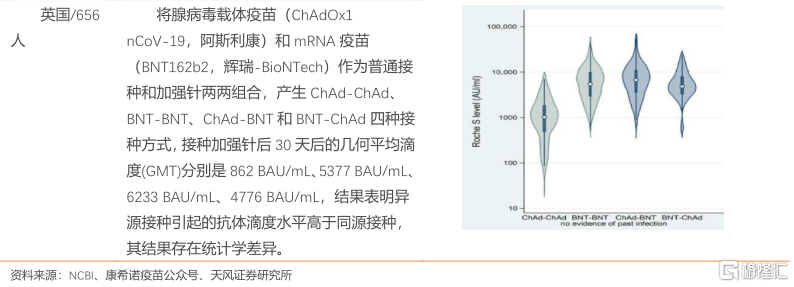
多项临床研究针对疫苗同源加强和/或异源加强进行分析,同源加强和异源加强均提升中和抗体水平,且部分研究显示异源接种引起的中和抗体滴度水平高于同源接种。



2.2. 中国加强免疫接种仍为免费接种,预计需求约6.80亿人
根据wind,截至2022年3月4日中国累计接种新冠疫苗约31.52亿剂次,截至2022年2月25日,疫苗接种总人数为12.69亿,其中完成全程接种12.34亿人,已完成第三针加强免疫接种人数约5.54亿,未来第三针加强新冠疫苗接种需求约6.80亿人,占完成基础免疫的55%。目前序贯接种和同源接种一样为免费接种,优先在口岸、边境等重点地区实行,其他人群根据需要开展序贯加强免疫接种,我们预计第三针新冠疫苗各厂商将处于较为激烈的竞争状态。

3. 新冠口服药供不应求,国产产品正在临床试验
目前已有2款新冠口服药获批上市包括默沙东Molnupiravir以及辉瑞的Paxlovid。默沙东Molnupiravir已在英国、美国和日本等获得许可/紧急使用授权。近日,Molnupiravir获得WHO的推荐建议用于治疗高住院风险的轻症新冠患者。Molnupiravir的EUA申请是基于3期MOVe-OUT临床试验。在接受Molnupiravir治疗的患者中接受Molnupiravir治疗的患者在第29天住院或死亡率为7.3%(vs14.1%),在所有随机受试者中相对风险降低幅度为30%。辉瑞的Paxlovid已在英国、加拿大、美国和日本等获得批准/紧急使用授权,2022年2月获得中国附条件获批进口注册。在II/III期EPIC-HR试验(NCT04960202)中,Paxlovid使5天内出现症状并接受治疗的患者因任何原因住院或死亡的风险降低了88%,接受治疗的患者中在28天随访期间住院或死亡的概率由6.3% 降至0.8%,整体死亡率由1.1%下降至0。
此外,日本盐野义的口服新冠药S-217622已基于IIb期临床数据向PMDA提交有条件批准申请。IIb期临床结果显示S-217622能快速降低病毒滴度和病毒RNA,在S-217622治疗组中病毒滴度阳性的受试者比例下降了约60-80%,新型冠状病毒病毒滴度阴性的平均时间缩短了2天,同时也展现了良好的安全性。

由于新冠口服药物疗效明确、服用方便、可及性强,已逐渐成为各国政府抗疫采购主流趋势。从美国政府新冠药物采购数据可以看出,自新冠口服药上市后,美国政府采购抗体药物数量趋势下降,新冠口服药物采购趋势明显上涨。据各国政府报道,针对辉瑞Paxlovid,美国、英国、日本已分别累计采购2000万、275万、200万疗程;针对默沙东Molnupiravir,美国、英国、日本已分别累计采购950万、230万和160万疗程。

3.1.辉瑞Paxlovid供应链
目前辉瑞Paxlovid已在美国、欧盟和中国等全球多个国家上市,为扩大全球药品可及性,辉瑞正在积极提升产能,根据辉瑞2021年年报数据,预计2022年上半年Paxlovid产量将达3千万疗程,下半年预计为9千万疗程,全年为1.2亿疗程,Paxlovid全年销售额预计为220亿美元。
Paxlovid是Nirmatrelvir与Ritonavir的复方制剂,其中Ritonavir为已上市药物利托那韦,Nirmatrelvir为新冠病毒3CL蛋白酶抑制剂的新分子实体。Nirmatrelvir的生产工艺路线与供应链体系均需重新构建,所涉供应链包括CDMO与医药中间体供应商。我们认为未来随着Paxlovid的全球范围获批与MPP协议的全球销售,相关供应链订单需求量可观且有望保持扩张。
3.1.1. Nirmatrelvir CDMO供应链
新冠口服药物强劲需求或将催生优质原料药供应需求。Paxlovid的服用方式为每日两次(间隔12小时),每次三片(两片150mg“Nirmatrelvir”和一片100mg“Ritonavir”),一个疗程需服用五天。按照目前辉瑞2022年计划供应1.2亿疗程来计算,不考虑原料消耗,Nirmatrelvir原料药的需求为360吨,Ritonavir原料药的需求为120吨,全球市场对Paxlovid的强劲需求或将催生优质原料药快速供应的需求。
在全球外包产能需求旺盛的背景下,国内CDMO公司的领先技术、充足产能、国际化合规体系与IP保护,以及全球突发事件中体现的稳定供应与交付效率,为国内CDMO公司带来更多机遇。国内凯莱英、博腾股份等CDMO公司已公吿获得大额订单,凯莱英分别于2021年11月17日、2021年11月29日公吿4.81亿美元、27.20亿元订单,博腾股份分别于2021年11月30日、2022年2月11日公吿2.17亿美元、6.81亿元订单,订单供应时间截至2022年。重磅订单的获得充分凸显国内CDMO公司在全球范围内的综合竞争力,为后续更多优质订单的获取树立品牌效应,助力国内CDMO公司加速产业转型升级,获得更长远的生命力。

3.1.2. Nirmatrelvir中间体供应链
辉瑞Paxlovid在全球范围内的获批有望带动上游中间体产业链。根据辉瑞在Science发表的文章,推测Nirmatrelvir的工艺路线由3个片段分别生产后拼接合成,整个生产路线中涉及多个中间体化合物的供应。辉瑞已与药品专利池(MPP)签署Paxlovid许可协议,获得MPP授权的合格仿制药生产商将为95个国家提供Paxlovid,覆盖全球53%人口。中国作为全球最大的医药中间体/原料药生产和出口地区,在全球医药产业链占据重要地位,国内原料药企业具备Nirmatrelvir从原料-中间体-原料药的全产业链供应能力,随着Paxlovid的多国获批与MPP协议的全球销售,Nirmatrelvir合成路线所涉中间体/原料药的订单需求有望进一步扩大。


3.1.3. 利托那韦供应链
Ritonavir为已上市药物利托那韦,利托那韦是一款抗艾滋病毒药物,原研药企业为Abbvie,Abbvie于2020年3月23日放弃利托那韦全球专利权,以面对可能威胁全球的药物供应短缺问题。据国家药品监督管理局(NMPA)信息,截至目前,国内共有四家企业获批生产利托那韦:歌礼药业(浙江)有限公司、上海迪赛诺化学制药有限公司、万全万特制药(厦门)有限公司、广东东阳光药业有限公司。据各公司公吿,歌礼药业利托那韦口服片剂年产能已扩大至1亿片,未来根据市场需求可进一步快速扩大;精华制药(森萱医药)、海特生物均具有成熟的利托那韦片关键中间体生产技术。

3.2. 默沙东Molnupiravir供应链
默沙东Molnupiravir于2021年11月4日在英国获批上市,2021年12月23日获得美国FDA紧急使用授权,2021年销售额为9.52亿美元。截至2022年2月19日,默沙东已向20多个获得批准上市或使用授权的国家/地区交付Molnupiravir,已与联合国儿童基金会达成协议,2022年上半年将向中低收入国家调配总计300万疗程。
供应规模提升拉动供应链需求扩张。据默沙东公吿,截至2021年底已生产1000万疗程Molnupiravir,预计2022年将生产至少2000万疗程Molnupiravir。Molnupiravir的服用方式为每日两次(间隔12小时),每次4片(200mg/片),一个疗程需服用五天。按照目前默沙东2022年计划供应2000万疗程来计算,不考虑原料消耗,对Molnupiravir原料药的需求为160吨。

默沙东在ACS Central Science发表的论文表明,该研究团队以核糖为原料,采用工程激酶Ribosyl-1激酶和尿苷磷酸化酶,开发三步法合成路线,新合成路线比原胞嘧啶起始路线总产率提高7倍。据公司公吿,天宇股份为默沙东Molnupiravir提供中间体CMO服务。
默沙东与药品专利池组织(MPP)达成协议,增加Molnupiravir在105个国家的供应,2022年1月20日MPP宣布,与27家仿制药制造公司签订协议将为全球105个中低收入国家或地区生产及供应Molnupiravir仿制药,其中有5家中国药企入围协议名单,复星医药、博瑞医药、龙泽制药与迪赛诺获许可同时生产Molnupiravir原料药和制剂,维亚生物旗下朗华制药获许生产Molnupiravir原料药。随着Molnupiravir的全球推广与MPP协议的全球销售,Molnupiravir市场有望进一步打开。
3.3. 国产新冠药物正在临床试验
3.3.1. 国产新冠药RdRp抑制剂进展
RdRp抑制剂的主要作用机理是通过阻断RNA聚合酶(RdRp)的合成来阻断冠状病毒。目前中国多家药企积极开展新冠口服药研发布局,其中君实生物、真实生物已进入III期临床试验阶段。君实生物VV116已获得乌兹别克斯坦紧急使用授权(EUA),VV116已于中国完成的I期临床研究以及此前于乌兹别克斯坦针对中重度患者进行的临床研究均显示出其符合预期的安全性和有效性。目前正在开展一项国际多中心III期试验,轻中症患者试验计划入组2000人。另一款RdRp抑制剂真实生物的阿兹夫定正在中国、巴西及俄罗斯分别开展III期试验,其中,在巴西开展的针对中重度新冠肺炎患者的III期试验 (NCT04668235)预计在2022年4月完成,针对轻症患者试验(NCT05033145)预计2022年7月完成。歌礼制药ASC10计划于2022年H1在中美等地进行IND申报。

3.3.2. 国产新冠药3CLpro抑制剂及其他类型药物进展
3CL 蛋白酶抑制剂能抑制3CL蛋白酶的活性,阻断冠状病毒的复制过程,在治疗新冠病毒感染方面具有显著优势。前沿生物、君实生物及先声药业等多家药企布局与辉瑞Paxlovid同机制的3CLpro抑制剂研发,目前除前沿生物(FB2001,注射剂)进入I期试验外,其他药企尚处于临床前研究阶段。据君实生物投资者关系记录,根据VV993的临床前研究和抗病毒研究数据,VV993单药即显示出良好的有效性和安全性。先声药业的SIM0417在动物模型中显示了良好的抗病毒活性和安全性;广生堂发布公吿称其获得具有相当药效的预选临床前候选化合物;云顶新耀授权引入新加坡A*ccelerate的新冠口服药EDDC-2214,预计于2022年开展临床试验;歌礼制药ASC11计划于2022年H2在中美等地进行IND申报。
开拓药业的雄激素受体拮抗剂普克鲁胺则在乌拉圭获批EUA,但其针对轻中症非住院患者的III期试验中期分析未达到终点。目前公司正在开展重症住院患者的III期临床研究,以及轻中症全球III期临床试验。2月14日,治疗轻中症新冠全球III期临床试验完成中国首例受试者给药。

4. 投资建议
新冠疫情预计中长期与人类共存,疫情走向不确定因素较高,建议从三个维度筛选主题投资机会:1)需求持续性好,2)竞争格局较优,3)传统业务具备估值一定支撑。相关标的:
1)新冠抗原检测:东方生物、万孚生物、安旭生物、博拓生物、奥泰生物;
2)疫苗加强针:智飞生物、康希诺、康泰生物;
3)新冠药:君实生物、以岭药业;
4)CDMO供应链:药明康德、凯莱英、博腾股份。
5. 风险提示
1) 新冠病毒变异风险;新冠病毒如果发生变异,全球有可能引发再一次大流行,各国政府防疫政策或有所改变,检测、疫苗、治疗药的需求不确定性较高。
2) 新冠抗原检测放开不及预期;中国新冠抗原检测不放开,抗原检测相关的公司无法在中国销售,业绩会有一定的影响。
3) 新冠疫苗接种不及预期;中国新冠疫苗加强针接种不及预期,免疫屏障或无法建立,防疫政策或无法放开。
4) 新冠药产业链公司参与存在不确定性。梳理产业链公司仅代表公司存在相关产品的生产能力,不代表我们认为相关公司已参与或将参与新冠药产业链。
5) 新冠药物研发不及预期;
6) 新冠药制备工艺存在不确定性,为分析师主观分析。
报吿来源:天风证券股份有限公司
报吿发布时间:2022年3月8日
本资料为格隆汇经天风证券股份有限公司授权发布,未经天风证券股份有限公司事先书面许可,任何人不得以任何方式或方法修改、翻版、分发、转载、复制、发表、许可或仿制本资料内容。
免责声明:市场有风险,投资需谨慎。本资料内容和意见仅供参考,不构成对任何人的投资建议(专家、嘉宾或其他天风证券股份有限公司以外的人士的演讲、交流或会议纪要等仅代表其本人或其所在机构之观点),亦不构成任何保证,接收人不应单纯依靠本资料的信息而取代自身的独立判断,应自主做出投资决策并自行承担风险。根据《证券期货投资者适当性管理办法》,若您并非专业投资者,为保证服务质量、控制投资风险,请勿订阅本资料中的信息,本资料难以设置访问权限,若给您造成不便,还请见谅。在任何情况下,作者及作者所在团队、天风证券股份有限公司不对任何人因使用本资料中的任何内容所引致的任何损失负任何责任。本资料授权发布旨在沟通研究信息,交流研究经验,本平台不是天风证券股份有限公司研究报吿的发布平台,所发布观点不代表天风证券股份有限公司观点。任何完整的研究观点应以天风证券股份有限公司正式发布的报吿为准。本资料内容仅反映作者于发出完整报吿当日或发布本资料内容当日的判断,可随时更改且不予通吿。本资料内容不构成对具体证券在具体价位、具体时点、具体市场表现的判断或投资建议,不能够等同于指导具体投资的操作性意见。



