在疫情籠罩下,剛剛過去的聖誕節顯得格外危險。疫情最為嚴重的英國,單日確診數量再創歷史新高,日增超12萬例。美國的疫情形式同樣不容樂觀,單日確診數量超20萬例。僅不到一個月的時間裏,全美50個州均已報吿新冠變異株奧密克戎的感染病例。新冠疫情持續反覆,患者數量也日益增長,用於治療新冠的藥物開發顯得格外重要。
在新冠疫情流感化的進程中,小分子口服藥物是控制疫情的關鍵手段之一。但是目前僅有海外巨頭默沙東的Molnupiravir和輝瑞的PAXLOVID這兩款藥物獲得僅針對特殊高風險非住院患者的美國EUA(緊急使用授權)。而反觀國產的新冠治療藥物,在中國以外無一獲批。其中進度最快的小分子口服藥物來自開拓藥業,在2021年12月27日公佈了其雄激素受體拮抗劑普克魯胺治療輕中症新冠患者的III期全球多中心臨牀試驗(NCT04870606)的中期分析進展。那麼,該如何來看這份國產新冠口服藥物的中期結果?
普克魯胺III期臨牀試驗方案調整,繼續招募高風險新冠患者
筆者瞭解到,開拓藥業的新冠口服藥物普克魯胺,其用於治療輕中症非住院新冠患者的研究是一項隨機、雙盲、安慰劑對照、全球多中心的III期關鍵性臨牀試驗。此次中期分析入組了348名輕中症新冠患者,均為5天內出現症狀。患者被隨機分到普克魯胺治療組(200mg普克魯胺)或安慰劑對照組,每天口服兩次,持續14天。臨牀試驗的主要終點為28天內,患者住院(超過24小時)和死亡的百分比。
對於一款藥物而言,最重要的就是其有效性和安全性。開拓藥業的公吿顯示,在有效性方面,公司的普克魯胺用於治療輕中症新冠患者的III期臨牀試驗中期分析沒有達到統計學顯著性。而在安全性方面,在臨牀試驗中沒有發生安全性問題,也沒有一例藥物相關的嚴重不良事件(SAEs)的報吿出現。
看到這裏,或許有些人就武斷地認為開拓藥業的新冠口服藥物研發失利。但實則不然。筆者認為,此次公吿的重點是“公司計劃調整臨牀試驗方案並尋求獲得美國FDA等監管機構的同意,繼續招募只有基礎性疾病和/或無新冠疫苗接種史的高風險新冠患者”。
圖一:開拓藥業公佈普克魯胺III期臨牀試驗進展

資料來源:公司公吿,格隆彙整理
不同於停止臨牀試驗,公司的小分子口服新冠藥物普克魯胺有望通過臨牀研究的方案調整,重新獲得統計學的顯著性驗證。筆者認為其仍然具備十足的潛力。我們不妨從以下幾點來看:
第一,開拓藥業的III期臨牀試驗中期結果受限於樣本數量,後續增加樣本有望獲得更加真實的數據。
一般而言,臨牀試驗的樣本量越大越能證明數據的真實性,樣本量較少則有可能因小概率事件的發生而得到非真實的結論。從現有產品獲批的公司來看,默沙東和輝瑞作為全球醫藥巨頭,在很短的時間內完成受試者的招募,其取得較為理想的數據是在充足的樣本量(超1000名患者的規模)基礎上所開展的臨牀試驗。
由於普克魯胺這款新冠口服藥物的開發需要在海外進行臨牀試驗,在財力、人力、影響力方面註定中國本土的Biotech難與國際大型藥企並肩,開拓藥業為加快臨牀試驗的進度,無法避免地犧牲了一定的樣本量。所以,在樣本量有限(中期分析包含348例輕中症非住院新冠患者)的臨牀試驗中,公司的普克魯胺在有效性方面沒有達到統計學顯著性或是基於不夠充分的樣本量所得到的結論。
第二,公司試驗設計方面難度更大,所招募的患者沒有設置基礎病和接種疫苗的限制,若加以限定或能達到明顯的對比效果。
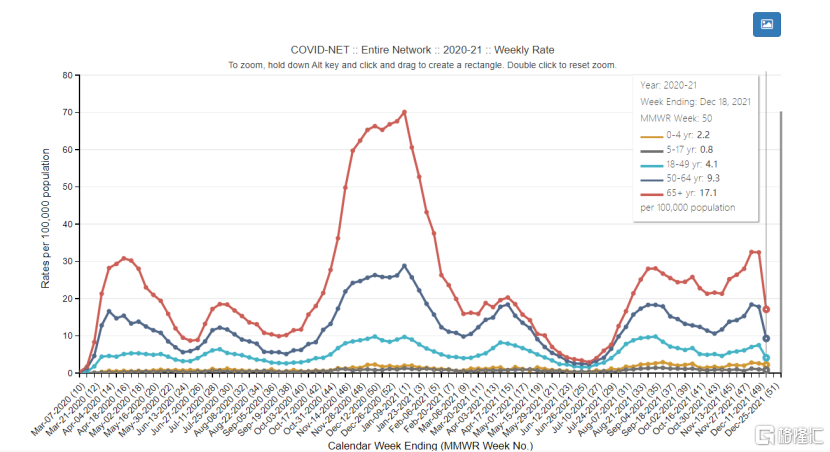
除了樣本數量以外,開拓藥業的臨牀試驗招募患者條件更加開放。其中期分析數據中入組的患者均來自美國,而美國新冠患者的總體住院率相對較低,此外還有相當比例的患者接種過新冠疫苗(甚至是被普遍認為保護效力最高的mRNA疫苗)。從這一方面來看,若患者接種了具有較高保護效力的新冠疫苗,本身或就不易轉重症乃至住院,可能顯著降低對照組的住院率。
圖二:美國分年齡段的新冠住院率(每週)
資料來源:美國CDC官網,格隆彙整理
對比默沙東和輝瑞的入組患者情況,可以發現所選擇的均為高風險人羣,這些患者尚未接種疫苗,且至少有一項可能導致病情加重的基礎病,從而為藥物降低住院率提供機會。然而,開拓藥業的普克魯胺在臨牀試驗卻沒有基礎病的設置,這也會降低對照組的住院率。由於這些擾動項的存在,公司的普克魯胺若要顯示出更高的降低住院率難度更大。
值得一提的是,開拓藥業表示,公司將會繼續開展新冠藥物的臨牀試驗,截至2021年12月23日已完成所有患者招募,95%的患者來自美國。而且,公司將與監管機構包括美國FDA等溝通以調整該項臨牀試驗的方案,在徵得監管機構的同意後繼續招募只有基礎性疾病和/或無新冠疫苗接種史的高風險新冠患者進行臨牀試驗。根據目前普克魯胺治療輕中症新冠患者所呈現出的積極趨勢,通過增加樣本量、限制患者類型後,筆者相信在高風險新冠患者的臨牀試驗中,公司的普克魯胺能夠在有效性方面實現統計學上的顯著性。
第三,公司的普克魯胺在安全性與適用範圍方面仍有較大的優勢,全球三個多中心臨牀試驗同時開展,有望成為首個國產的新冠口服藥物。
在有效性方面,開拓藥業可以通過調整臨牀試驗的方案得到較好的解決。再來看安全性方面,筆者認為投資者無需過於擔憂。在III期關鍵性臨牀試驗中,儘管由於目前臨牀試驗還在繼續進行中,數據還是盲態,但是基於中期分析結果,公司的普克魯胺在安全性方面得到了一定的驗證,研究中無安全性問題,且沒有一例藥物相關的嚴重不良事件報吿。
而且,這款藥物還是唯一一個進入全球註冊性臨牀三期試驗用於治療新冠重症患者的國產小分子口服藥物。更為難得的是,其在新冠的全治療週期內均有效。無論是在輕中症的新冠患者,還是在重症的新冠患者中,這款藥物都呈現出了一定的治療效果。相比於默沙東和輝瑞的藥物只能用於輕中症患者,開拓藥業的普克魯胺適用範圍更大,將為更多類型的新冠患者帶來福音。
此外,公司同時在進行三項普克魯胺用於新冠治療的III期全球多中心臨牀試驗,該中期分析僅是三個全球多中心臨牀試驗中的一個結果。另外,公司還在巴西、中國等國家開展一項普克魯胺用於輕中症非住院新冠患者的III期全球多中心臨牀試驗,以及在美國、巴西、中國等國家開展另一項用於重症住院新冠患者的III期全球多中心臨牀試驗。
從其他地區進行的臨牀試驗來看,此前在巴西開展的治療輕中症、重症新冠患者的研究試驗中,普克魯胺則是展示出了十分搶眼的有效性和安全性。針對輕中症新冠患者的三期臨牀試驗結果顯示,其預防輕中症轉為重症住院的保護率分別為92%和90%,預防轉入重症加強護理病房或死亡的保護率均為100%。
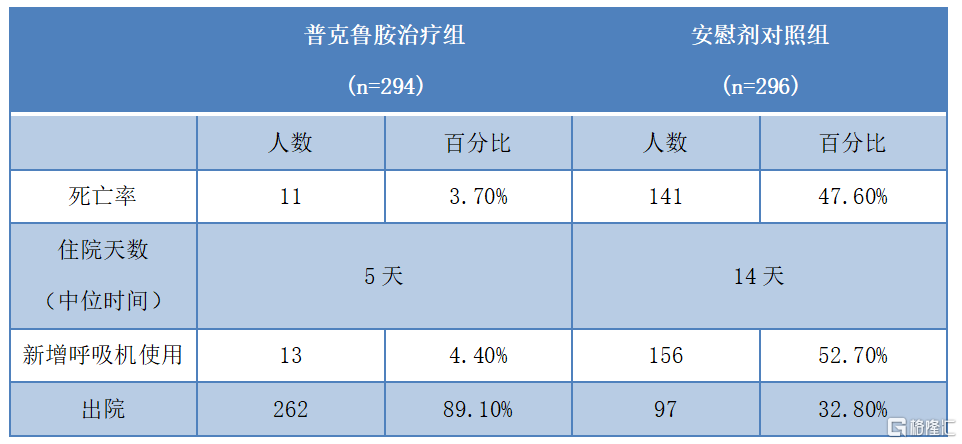
而在針對重症新冠患者的結果顯示,普克魯胺將重症新冠患者的死亡風險降低了78%,並平均縮短住院時間9天(安慰劑對照組需要14天)。另外,巴西經普克魯胺“同情用藥”治療後的危重症新冠患者的插管治療和死亡人數都顯著減少。
圖三:巴西進行的普克魯胺治療重症新冠患者的臨牀試驗
資料來源:公司官網,格隆彙整理
基於臨牀試驗中展示的良好效果,2021年7月16日,普克魯胺也在巴拉圭(南美洲中部的一個內陸國家)獲得首個緊急使用授權(EUA)。來自真實世界的數據更是再次驗證,普克魯胺治療重症新冠患者的療效與此前在巴西的臨牀試驗結果一致。
目前這些臨牀試驗都在有序開展中,公司也會根據此次中期分析的結果來考慮調整其他兩項臨牀試驗的方案設計。在新冠藥物開發與佈局中,開拓藥業明顯呈現出較強的韌性,雖然此次臨牀試驗受阻,但能夠從中看出公司具備快速響應並積極調整臨牀試驗方案的強大能力。憑藉在其他地區的成功經驗以及公司擁有的多重優勢,普克魯胺有望成為首個國產的新冠口服藥物。
小結
如今,全球新冠疫情仍在逐漸加重,奧密克戎等新冠變異株的不斷出現,新冠疫情流感化的治療逐步成為業界共識。而回顧百年流感歷史,真正讓人類社會免於流感影響的手段是“流感疫苗+口服抗病毒藥”的“防+治”組合。同樣地,從防治範式上來看,“新冠疫苗+口服抗新冠藥”也是一個值得參考的方案,這更加凸顯了對新冠治療藥物的需求。從目前獲批上市的新冠口服藥物銷售情況來看,輝瑞推出的首批6.5萬個療程新冠特效藥更是早已被美國各州一搶而空,新冠口服藥物的需求量可見一斑。
此次開拓藥業公佈的普克魯胺用於治療輕中症新冠患者的III期全球多中心臨牀試驗中期分析結果中,儘管由於事件數較少沒有達到統計學顯著性,但是公司依然表示還將會繼續開展研究,通過調整臨牀試驗方案等措施有望重獲統計學顯著性的驗證。據此,筆者認為開拓藥業的普克魯胺將會成為新冠口服特效藥物,給全球新冠患者帶來福音的同時公司也將獲得相應的收益。筆者也期待在全球新冠口服藥物隊伍中能看到中國本土企業的身影。



